PH INDICADORES
TRABAJO PH INDICADORES
VALENTINA REYES VILLANUEVA
DIANA JARAMILLO
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
10-1
IBAGUE-TOLIMA
INTRODUCCIÓN
A continuación vamos hablar sobre el PH - INDICADORES , NEUTRALIZACION , TORNASOL,FENOLFTALEINA , UNIVERSAL,TITULACIÓN y
vamos a identificar las características de cada uno y aprender mas acerca de lo que suceda
vamos a identificar las características de cada uno y aprender mas acerca de lo que suceda
OBJETIVOS
- Aprender mas acerca de los temas
- conocer diferentes procedimientos químicos
MARCO TEÓRICO
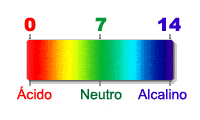
Es una sustancia que permite medir el pH de un medio. Habitualmente, se utilizan como indicador de las sustancias químicas que cambian su color al cambiar el pH de la disolución. El cambio de color se debe a un cambio estructural inducido por la protonación o desproporcionar de la especie.

Los indicadores Ácido-base tienen un intervalo de viraje de una unidad arriba y otra abajo de pH, en la que cambian la disolución en la que se encuentran de un color a otro, o de una disolución incolora, a una coloreada.
Los más conocidos son el naranja de metilo, que vira en el intervalo de pH 3,1 - 4,4, de color rojo a naranja, y la fenolftaleína, que vira desde un pH 8 hasta un pH 10, transformando disoluciones incoloras en disoluciones con colores rosados / violetas.

TORNASOL
En una titulación, el punto en que la cantidad de reactivo titulado adicionado es exactamente suficiente para que se combine en una proporción estequiométrica, o empíricamente reproducirle con la sustancia que se determina, se llama punto de equivalencia.
El punto final de una titulación debe coincidir con el punto de equivalencia o estar muy próximo de él. La diferencia entre los puntos de equivalencia y final se llama intervalo del indicador.
Las titulaciones se realizan casi siempre con soluciones o disoluciones, sin embargo también es fácil realizarlas con sustancias en los estados gaseosos, sólido y de fusión, si se dispone de equipo adecuado.
El punto final de una titulación debe coincidir con el punto de equivalencia o estar muy próximo de él. La diferencia entre los puntos de equivalencia y final se llama intervalo del indicador.
Las titulaciones se realizan casi siempre con soluciones o disoluciones, sin embargo también es fácil realizarlas con sustancias en los estados gaseosos, sólido y de fusión, si se dispone de equipo adecuado.

NEUTRALIZACIÓN
PH- INDICADORES
- tornasol
B. Fenolftaleina
No pinta, quiere decir que es un ácido ,Cómo fenolftaleína cambia de color .
Este compuesto en realidad cambia de color a través de un proceso llamado ionización. La ionización es lo que sucede cuando se añaden o eliminan los iones de carga positiva o negativa de una molécula, que puede convertir la molécula en un ion. Phenolphthalein contiene iones de hidrógeno cargados positivamente, pero cuando se expone a una solución alcalina, se eliminan estos iones. En general, la molécula de fenolftaleína es incolora naturalmente, pero su ion es de color rosa brillante, por supuesto. Cuando los iones de hidrógeno se eliminan de la solución, fenolftaleína molécula incoloro ioniza y cambios a iones de fenolftaleína de color rosa. Cuanto más fuerte sea la solución alcalina es, más iones de hidrógeno se eliminan y las sombras oscuras de la fenolftaleína rosa será.
c.UNIVERSAL
TITULACIÓN
la respuesta es la b
CONCLUSIONES
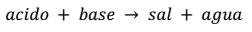
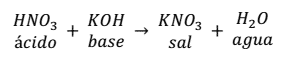
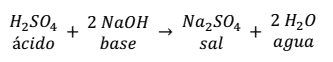
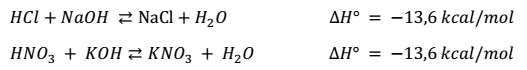




LOS INFORMES ERAN POR SEPARADO FALTO MAS MARCO TEORICO 3,5
ResponderEliminar