TRABAJO REACCIÓN QUÍMICA
TRABAJO REACCIONES QUÍMICAS
VALENTINA REYES VILLANUEVA
DIANA JARAMILLO
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
10-1
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
Conocer con profundidad acerca de la Reacción química , Ecuación química , como se escribe una ecuación , y clases de reacciones. Aprender aquellas definiciones que no teníamos conocimientos.
OBJETIVOS
- Conocer nuevos conceptos
- Saber los pasos que lleva la reacción
REACCIÓN QUÍMICA
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos.
Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
La física reconoce dos grandes modelos de reacciones químicas, las reacciones ácido-base, que no presentan modificaciones en los estados de oxidación y las reacciones redox, que por el contrario sí presentan modificaciones en los estados de oxidación.
En tanto, dependiendo del tipo de productos que resulta de la reacción a las reacciones químicas se las clasifica de la siguiente manera: reacción de síntesis (elementos o compuestos simples se unen para conformar un compuesto más complejo), reacción de descomposición (el compuesto se fragmenta en elementos o compuestos más simples; un solo reactivo se convierte en productos), reacción de desplazamiento o simple sustitución (un elemento reemplaza a otro en un compuesto) y reacción de doble desplazamiento o doble sustitución (los iones de un compuesto modifican lugares con los propios de otro compuesto para conformar dos sustancias diferentes).

Principales Reacciones Químicas
Reacción Ácido-Base: también llamada reacción de centralización, es aquella que ocurre entre un ácido y una base para dar lugar a una sal y agua:
HCl + NaOH → NaCl + H2O
H2SO4 + 2 NaOH → Na2SO4 + H2O
...
Reacción de Adición: uno o varios átomos se unen a una molécula que posee un doble o triple enlace destruyéndolo. Se dan principalmente en química orgánica:
CH2=CH2 + HBr → CH3-CH2Br
CH2=CH2 + H-H → CH3-CH3
...
Reacción en Cadena: en ella, los productos de la reacción pueden producir reacciones adicionales repitiéndose el ciclo indefinidamente.
Reacción de Combinación: también llamada reacción de síntesis, es aquella en la que se unen dos o más sustancias para formar otra cuyo resultado es la re agrupación de los átomos iniciales (A + B → AB):
N2 + 3 H2 → 2 NH3
Cl2 +H2 → 2 HCl
2 Na + Cl2 → 2 NaCl
SO3 + H2O → H2SO4
...
Reacción de Condensación: en química orgánica es aquella reacción en la que dos moléculas se unen para dar un único producto más agua.
CH3COOH + CH3OH → CH3COOCH3 + H2O
...
Reacción de Descomposición: es la reacción contraria a la de combinación. Ocurre cuando a partir de un compuesto se forman dos o más sustancias (AB → A + B):
2 H2O → 2 H2 + O2
H2CO3 → CO2 + H2O
CaCO3 → CaO + CO2
...
Reacción de Desplazamiento: un elemento de un compuesto es sustituido por otro que está presente en la reacción (A + BC → B + AC):
2 NaI + Br2 → 2 NaBr + I2
...
Reacción de Disminución: también llamada reacción de desproporción, es aquella donde un elemento es simultáneamente oxidado y reducido:
2 H2O2 → 2 H2O + O2
...
Reacción de Doble Sustitución: se produce cuando dos compuestos intercambian elementos produciéndose otros nuevos (AB + CD → CB + AD):
HCl + NaOH → NaCl + H2O (neutralización ácido-base)
...
Reacción Elemental: es aquella reacción que se produce en un único paso sin etapas intermedias o estados de transición.
Reacción de Eliminación: es el proceso contrario a la reacción de adición
CH3CH2CHBrCH3 + NaOH → CH3–CH=CH–CH3
CH3-CH2-CHOH-CH3 + H2SO4 → CH3–CH=CH–CH3
R-CH2-CH2-X → R-CH=CH2 + H-X
...
Reacción Exorgónica: reacción química donde la variación de la energía libre de Gibbs
Reacción Iónica: interacción eléctrica de especies iónicas solvatadas o dispersos en el disolvente:
Ag+ + Cl- → AgCl
Reacción Limitante: es el paso de una reacción que se produce más lentamente y que por lo tanto limita la velocidad de la reacción global.
Reacción Orgánica: son las reacciones de los compuestos orgánicos
Reacción Redox: reacción en la que existe una transferencia electrónica entre los reactivos. También se denomina reacción de oxidación-reducción
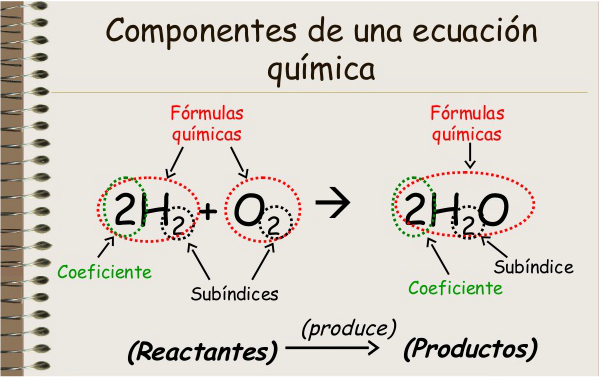
ECUACIÓN QUÍMICA
Una ecuación química es una descripción simbólica de una reacción química . Muestra las sustancias que reaccionan (llamadas reactivos ) y las sustancias que se originan (llamadas productos). La ecuación química ayuda a visualizar los reactivos que son los que tendrán una reacción química y los productos, que son las sustancias que se obtienen de este proceso. Además se pueden ubicar los símbolos químicos de cada uno de los elementos o compuestos que estén dentro de la ecuación y poder balancearlos con mayor facilidad.
Requisitos para una ecuación química
Una ecuación química debe:
- Cumplir con la ley de conservación de la materia.
- Cumplir con la ley de conservación de la carga.
- Cumplir con la ley de conservación de la energía.
- Corresponder a un proceso real.
Concepto de ecuación química
Una reacción química es cualquier proceso en el que, por lo menos, los átomos, las moléculas o los iones de una sustancia se transforman en átomos, moléculas o iones de otra sustancia química distinta. Las reacciones químicas se escriben de forma simplificada mediante ecuaciones químicas.
En las reacciones químicas se cumple la ley de conservación de la masa, teniendo lugar una reordenación de los átomos, pero no su creación ni su destrucción. El reordenamiento de los átomos en la molécula da lugar a una sustancia distinta.
Las sustancias que se transforman o modifican en una reacción se llaman reaccionantes, reactivos o reactantes. Las sustancias nuevas que se originan en una reacción química se llaman productos.
Una de las reacciones químicas más usuales es la combustión del gas natural (mezcla de sustancias donde el metano, CH4, es el compuesto principal), cuya ecuación es:
La ecuación está «igualada», esto es, en cada miembro de la reacción hay el mismo número de átomos de cada elemento.

Ajuste de las ecuaciones químicas
Para ajustar una ecuación química hay que seguir el orden siguiente:
- Primero se ajustan los átomos de los metales, teniendo prioridad los más pesados.
- A continuación se ajustan los no metales, teniendo también prioridad los más pesados.
- Se revisa, si es necesario, el ajuste de los metales.
- Se comprueba el ajuste contando los átomos de hidrógeno y de oxígeno que intervienen.
Por ejemplo, para ajustar la reacción:
BaCl2 + Na2SO4 ® NaCl + BaSO4siguiendo el orden indicado:
- Se empieza por el metal Ba, que es el más pesado. Como en ambos miembros hay un átomo de bario, no es necesario ajustarlo. Se sigue por el otro metal, el Na.
- Dado que en el miembro de la izquierda hay dos átomos de Na debemos poner un 2 delante del NaCl de la derecha, quedando:
BaCl2 + Na2SO4 ® 2 NaCl + BaSO4
- Se siguen ajustando los no metales: cloro y azufre. Como ambos ya están ajustados y en ambos miembros existe igual número de átomos de oxígeno, se puede considerar que la reacción ya está completamente ajustada.
COMO SE ESCRIBE UNA ECUACIÓN QUÍMICA
Pasos para escribir las Ecuaciones Químicas

- Una ecuación química usa los símbolos y fórmulas de los reactivos y productos, y otros términos simbólicos para representar una reacción química. Las ecuaciones se escriben siguiendo los siguientes pasos:
- Los reactivos se separan de los productos con una flecha (
) que indica el sentido de la reacción. Una flecha doble (
) indica que la reacción se efectúa en ambas direcciones y establece un equilibrio entre los reactivos y los productos.
- Los reactivos se colocan a la izquierda y los productos a la derecha de la flecha. Un signo (+) se coloca entre cada reactivo y entre cada producto, cuando es necesario.
- Las condiciones necesarias para efectuar la reacción pueden, si se desea, colocarse arriba o abajo de la flecha o signo de igualdad. Por ejemplo, una letra delta mayúscula (
) colocada sobre la flecha (
) indica que se suministra calor a la reacción.
- Se colocan coeficientes (números enteros) frente a los símbolos de las sustancias (por ejemplo, 2 H2O) para equilibrar o balancear la ecuación e indicar el número de unidades fórmula (átomos, moléculas, moles, iones) de cada sustancia que reacciona o que se produce. Cuando no se indica número alguno, se sobrentiende que se trata de una unidad fórmula.
- El estado físico de la sustancias se indica mediante los siguientes símbolos: (s) para el estado sólido; (l) para el estado líquido; (g) para el estado gaseoso; y (ac) para las sustancias en solución acuosa.
- Empiece con las partes más complejas, es decir con los compuestos que tienen varios elementos. En algunos casos, simplemente consiste en ajustar primero los átomos diferentes al hidrógeno y al oxígeno.
- Ajuste el hidrógeno y el oxígeno agregando agua si es necesario, después de que todos los otros elementos estén balanceados.
- Deje los elementos en estado libre hasta el último momento, ya que cambiando los coeficientes de estos sólo cambian esta clase de átomos. Por ejemplo, cuando se escribe un 2 delante del H2O, se duplica el número de átomos de hidrógeno y oxígeno, pero cuando se escribe un 2 delante del Al sólo cambia el número de átomos de Al.
- Para reacciones con iones poliatómicos, ajuste el ion como grupo. Por ejemplo, el SO4-2 se ajusta como ion sulfato y no como átomos de S y átomos de O.
- Generalmente, si aparecen fracciones en la ecuación, se multiplica todo por el número más pequeño que elimine esta fracción. No es esencial hacer desaparecer las fracciones, sin embargo, es más simple en la mayoría de los casos. Además asegúrese al final, que todos los coeficientes estén en relación o proporción más baja posible; si no es el caso, simplifique.
Empezando por el fosfato de magnesio (la parte más compleja) y considerando el fosfato de magnesio como grupo, escribimos un 2 delante del H3PO4 para ajustar el grupo fosfato y un 3 delante de Mg(OH)2 para ajustar el Mg dando como resultado:
Únicamente nos queda el hidrógeno y el oxígeno. Observando el hidrógeno, hay 12 átomos en la izquierda y por tanto necesitamos escribir un 6 delante del H2O. De igual forma se ajustan también los átomos de O que son en total 14. Esto da finalmente:
CLASES DE REACCIONES QUÍMICAS
En la naturaleza se presenta una gran cantidad de reacciones químicas que permiten la transformación de la materia y la energía, permitiendo el debido funcionamiento de los sistemas. Consolidan así el principio básico de: la materia y la energía, no se crean ni se destruyen solo se transforma.
El gran número de reacciones que se presentan, por la regularidad de su procesos, se pueden clasificar en las siguientes clases de reacciones:
Hay varias clasificaciones de las reacciones químicas, de las que las más importantes son:
- Reacciones exotérmicas: aquellas en que se desprende calor durante la reacción:
2H2 + O2 ® 2 H2O + 136.000 calorías
- Reacciones endotérmicas: aquellas en las que se absorbe calor durante la reacción:
- Reacciones de descomposición o análisis: reacciones en que una sustancia se desdobla en dos sustancias diferentes más simples:
- Reacciones de composición o de síntesis: reacciones en que dos o más sustancias se combinan para formar una nueva:
- Reacciones de sustitución: un elemento sustituye a otro en una molécula:
AL INFORME DE BALANCEO LE FALTARON EJERCICIOS DE MAYOR NIVEL 4.5
ResponderEliminarH2+Br2=2HBr
ResponderEliminar